जिस विलयन की सांद्रता ज्ञात होती है उसे मानक विलयन कहतें हैं | जिसकी सांद्रता ज्ञात करनी होती है उसे मानक विलयन के निश्चित आयतन में धीरे धीरे करके मिलाते हैं |जैसे अभिक्रिया पूर्ण होती है रंग परिवर्तित हो जाता है (अंतिम बिंदु)|अज्ञात विलयन का प्रयुक्त आयतन पता चल जाता है | तुल्यांको के नियम का प्रयोग करके (n1×M1×V1= n2×M2×V2 )अज्ञात विलयन की मोलरता निकाल लेते हैं |इस प्रक्रिया को अनुमापन या टाइट्रेशन (Titration)कहतें हैं |इस प्रयोग को करने के लिए ब्यूरेट का प्रयोग करते हैं |ब्यूरेट में अज्ञात विलयन भरते हैं |ब्यूरेट एक नली होती है जिसके एक सिरे पर स्टॉप कॉक लगा होता है तथा नली अंशांकित (graduated)होती है | मानक विलयन को पिपेट से नाप कर (for example 25 मिली ) कोनिकल फ्लास्क में भरते हैं |

Class 12 की बोर्ड परीक्षा में केमिस्ट्री प्रैक्टिकल में अनुमापन से सम्बंधित एक प्रश्न होता है (UP Board में 4 marks का )जिसमे दिए गए KMn04 के विलयन की मोलरता ज्ञात करनी होती है तो इसे पहले से ही अच्छे से समझ लिया जाय और प्रयोग करके भी देख लिया जाय तो अच्छा है | इसे प्रैक्टिकल कॉपी में अथवा exam की कॉपी में कैसे लिखा जाय ये मैं यहाँ पर बता रहा हूँ|
प्रयोग संख्या -01
उद्देश्य :-आक्सैलिक अम्ल का M/30 सांद्रता का 250mL मानक विलयन बनाकर अनुमापन (Titration) द्वारा दिए गए KMnO4 विलयन की मोलरता ज्ञात कीजिए |
आवश्यक उपकरण एवं सामग्री :-ब्यूरेट, पिपेट, कोनिकल फ्लास्क, मापक फ्लास्क, ऑक्सेलिक अम्ल, रासायनिक तुला, KMnO4विलयन, बर्नर ,आसुत जल आदि |
सिद्धांत :- ऑक्सेलिक (H2C2O4.2H2O)अम्ल का M/30 सांद्रता का 250 mL मानक विलयन बनाने के लिए आवश्यक अम्ल की मात्रा(w)-
w =अणुभार×मोलरता×आयतन/1000
w =126×(1/30)×250/1000
w =1.050 ग्राम
रासायनिक तुला पर 1.050 ग्राम आक्सैलिक अम्ल तोल कर एक कोनिकल फ्लास्क में 250mL आसुत जल में घोलें तथा जल अपघटन रोकने के लिए थोड़ा सान्द्र H2SO4 मिलाये | इस M/30 आक्सैलिक अम्ल के सांद्रता वाले विलयन का अनुमापन KMnO4 विलयन से करने पर निम्न अभिक्रिया होती है-
MnO4– + 8H+ +5e– —> Mn++ 4H2O ]×2
C2O4– – —> 2CO2 + 2e– ]×5
अथवा सपूर्ण अभिक्रिया:-
2 MnO4– +16 H+ + 5 C2O4– – —->2Mn++ + 8H2O + 10CO2
सूचक :- KMnO4 एक स्वयं सूचक(self indicator)है|
अन्तिम बिन्दु :- रंगहीन से स्थायी गुलाबी
विधि :- (1)आक्सैलिक अम्ल (ठोस) की 1.050 ग्राम मात्रा को रासायनिक तुला पर तोलिये |
(2) तोली गयी मात्रा को कीप द्वारा बीकर में डालिए| इसमें धीरे-धीरे जल मिलाइये तथा थोड़ा सांद्र H2SO4 डालिए |
(3) दिए गए KMnO4 विलयन को ब्यूरेट में भरिए तथा ब्यूरेट में भरे इस विलयन के तल का पाठ्यांक नोट कीजिये |
(4) M/30 सांद्रता के बनाये गए आक्सैलिक अम्ल के विलयन को पिपेट की सहायता से कोनिकल फ्लास्क में डालिये |
(5) इस विलयन में एक परखनली भरकर तनु H2SO4 मिलाइये ,तथा इसे लगभग 60-700C तक गर्म कीजिये |
(6) अब ब्यूरेट से KMnO4 विलयन को बूँद-बूँद करके कोनिकल फ्लास्क में आक्सैलिक अम्ल में तब तक मिलाइये जब तब विलयन स्थायी रूप से हल्का गुलाबी न हो जाए | इस दौरान फ्लास्क को हिलाते रहिये |
(7) इस प्रयोग की 3-4 बार पुनरावृत्ति कीजिये तथा कम से कम तीन समान पाठयांक लीजिये |
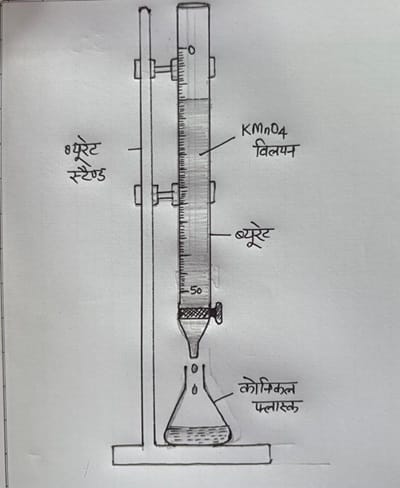
प्रेक्षण :- (1) तोलन नली का लगभग भार =7.8 gram
(2) तोलन नली+आक्सैलिक अम्ल का भार= 8.850 gram
(3) खाली तोलन नली का सही भार =7.8842 gram
(4) आक्सैलिक अम्ल का भार =1.050 gram
(5) पिपेट की धारिता = 25mL
Observation Table
| क्र0 सं0 | आक्सैलिक अम्ल | ब्यूरेट का पाठयांक (Initial) | ब्यूरेट का पाठयांक (Final) | प्रयुक्त KMnO4 |
|---|---|---|---|---|
| 1 | 25 mL | 0.00 mL | 6.6 mL | 6.6 mL |
| 2 | 25 mL | 0.00 mL | 6.7 mL | 6.7 mL |
| 3 | 25 mL | 0.00 mL | 6.7 mL | 6.7 mL |
प्रयुक्त KMnO4 =6.7 mL (समान पाठयांक)
गणनाएं :-N1×V1 (KMn04) =N2×V2 (आक्सैलिक अम्ल)
n1×M1×V1(KMn04)= n2×M2×V2(आक्सैलिक अम्ल)
5×M1×6.7 = 2×(1/30) ×25
M1 = 0.05 mol/L
परिणाम :-दिए गए विलयन की मोलरता = 0.05 M
सावधानियां :-
(1) अनुमापन करते समय ब्यूरेट के ऊपर से फनल (कीप) हटा देना चाहिए |
(2) कोनिकल फ्लास्क को आक्सैलिक अमल विलयन से खंगालना चाहिए |
(3) ब्यूरेट के जेट में वायु के बुलबुले नहीं रहने चाहिए |
(4) पिपेट की नोक में बचा द्रव फूँक मार कर नहीं निकालना चाहिए क्योंकि वह निर्धारित आयतन से अतिरिक्त होता है|
Note: Readings will differ on doing actual experiment)
अनुमापन फेरस अमोनियम सल्फेट तथा KMnO4 के मध्य
प्रयोग संख्या -02
उद्देश्य : फेरस अमोनियम सल्फेट का M/15 सांद्रता का 250mL मानक विलयन बनाकर अनुमापन (Titration) द्वारा दिए गए KMnO4 विलयन की मोलरता ज्ञात कीजिए |
आवश्यक उपकरण एवं सामग्री :-ब्यूरेट, पिपेट, कोनिकल फ्लास्क, मापक फ्लास्क,फेरस अमोनियम सल्फेट , रासायनिक तुला, KMnO4विलयन ,आसुत जल आदि |
सिद्धांत :- फेरस अमोनियम सल्फेट का M/15 सांद्रता का 250 mL मानक विलयन बनाने के लिए आवश्यक अम्ल की मात्रा(w)-
w =अणुभार×मोलरता×आयतन/1000
w =392×(1/15)×250/1000
w =6.533 ग्राम
रासायनिक तुला पर 6.533 ग्राम फेरस अमोनियम सल्फेट तोल कर एक कोनिकल फ्लास्क में 250mL आसुत जल में घोलें I इस M/15 फेरस अमोनियम सल्फेट के सांद्रता वाले विलयन का अनुमापन KMnO4 विलयन से करने पर निम्न अभिक्रिया होती है-
2KMnO4 + 3H2SO4 ———-> K2SO4 +2MnSO4 +3H2O 5[O]
[2FeSO4 +H2SO4 +[O] ———>Fe2(SO4)3 +H2O ]X5
अथवा सपूर्ण अभिक्रिया:-
KMnO4 + 10FeSO4 + 8H2SO4—-> K2SO4 +2MnSO4 + 5Fe(SO4)3 + 8H2O
सूचक :- KMnO4 एक स्वयं सूचक(self indicator)है|
अन्तिम बिन्दु :- रंगहीन से स्थायी गुलाबी
विधि :- (1) फेरस अमोनियम सल्फेट की 6.533 ग्राम मात्रा को रासायनिक तुला पर तोलिये |
(2) तोली गयी मात्रा को कांच की कीप द्वारा कोनिकल फ्लास्क में डालिए I इसमें धीरे-धीरे जल मिलाइये तथा थोड़ा सांद्र H2SO4 डालिए I
(3) दिए गए KMnO4 विलयन को ब्यूरेट में भरिए तथा ब्यूरेट में भरे इस विलयन के तल का पाठ्यांक नोट कीजिये I
(4) M/15 सांद्रता के बनाये गए फेरस अमोनियम सल्फेट के विलयन को पिपेट की सहायता से कोनिकल फ्लास्क में डालिये |
(5) इस विलयन में एक परखनली भरकर (10mL) तनु H2SO4 मिलाइये I
(6) अब ब्यूरेट से KMnO4 विलयन को बूँद-बूँद करके कोनिकल फ्लास्क में फेरस अमोनियम सल्फेट में तब तक मिलाइये जब तब विलयन स्थायी रूप से हल्का गुलाबी न हो जाए | इस दौरान फ्लास्क को हिलाते रहिये |
(7) इस प्रयोग की 3-4 बार पुनरावृत्ति कीजिये तथा कम से कम तीन समान पाठयांक लीजिये |
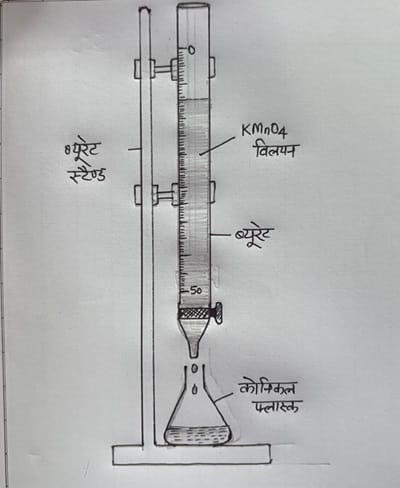
प्रेक्षण :- (1) तोलन नली का लगभग भार =7.8 gram
(2) तोलन नली+फेरस अमोनियम सल्फेट का भार= 14.333 gram
(3) खाली तोलन नली का सही भार =7.874 gram
(4) फेरस अमोनियम सल्फेट का भार=6.533 gram
(5) पिपेट की धारिता = 25mL
| क्र0 सं0 | फेरस अमोनियम सल्फेट | ब्यूरेट का पाठयांक (Initial) | ब्यूरेट का पाठयांक (Final) | प्रयुक्त KMnO4 |
|---|---|---|---|---|
| 1 | 25 mL | 0.00 mL | 10.1 mL | 10.1 mL |
| 2 | 25 mL | 0.00 mL | 10.0 mL | 10.0 mL |
| 3 | 25 mL | 0.00 mL | 10.0 mL | 10.0 mL |
प्रयुक्त KMnO4 =10.0 mL(समान पाठयांक)
गणनाएं :-N1×V1 (KMn04) =N2×V2 (फेरस अमोनियम सल्फेट)
n1×M1×V1(KMn04)= n2×M2×V2(फेरस अमोनियम सल्फेट)
5×M1×10.0 = 1×(1/15) ×25
M1 = 1/30 mol/L
परिणाम :-दिए गए विलयन की मोलरता = 1/30 M
सावधानियां :-
(1) अनुमापन करते समय ब्यूरेट के ऊपर से फनल (कीप) हटा देना चाहिए |
(2) कोनिकल फ्लास्क को फेरस अमोनियम सल्फेट विलयन से खंगालना चाहिए |
(3) ब्यूरेट के जेट में वायु के बुलबुले नहीं रहने चाहिए |
(4) पिपेट की नोक में बचा द्रव फूँक मार कर नहीं निकालना चाहिए क्योंकि वह निर्धारित आयतन से अतिरिक्त होता है|
