Atomic Structure is the second chapter of NCERT text book Class 11
परमाणु – तत्व के सूक्ष्मतम कण को परमाणु कहते है। ये कण रासायनिक अभिक्रियाओं में भाग लेते हैं । वैज्ञानिक जॉन डाल्टन ने सन 1804 में बताया कि परमाणु अविभाज्य है परन्तु सन 1897 में J. J. Thompson ने इलेक्ट्रॉन की खोज की ,सन 1919 में रदरफोर्ड ने प्रोटोन की खोज की , सन 1932 में चैडविक ने न्यूट्रॉन की खोज की और यह बताया कि सभी परमाणु इन कणों से बने होते हैं अतः परमाणु विभाज्य है । परमाणु सूक्ष्म कण है जो इलेक्ट्रॉन प्रोटोन तथा न्यूट्रॉन से बना होता है जिसके केंद्र में नाभिक होता है । परमाणु में इलेक्ट्रॉन नाभिक के चारो और चक्कर लगाते रहते हैं , प्रोटोन तथा न्यूट्रॉन नाभिक के अंदर रहते हैं ।
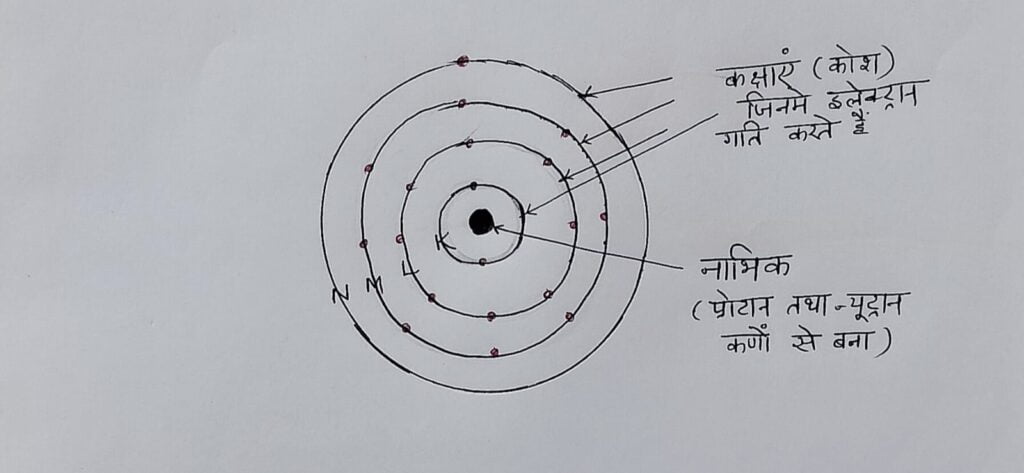
परमाणु क्रमांक – तत्व के परमाणु में उपस्थित प्रोटॉनों की संख्या को उस तत्व का परमाणु क्रमांक कहते हैं , इसे z से प्रदर्शित करते हैं ।
द्रव्यमान संख्या – तत्व के परमाणु के नाभिक में उपस्थित प्रोटॉनों तथा न्यूट्रॉनों की संख्या के योग को उस तत्व कि द्रव्यमान संख्या कहते हैं ।
परमाणु मॉडल
1 – थॉमसन का परमाणु मॉडल
2 – रदरफोर्ड का परमाणु मॉडल
3 – बोर का परमाणु मॉडल
4 – आधुनिक परमाणु मॉडल
दी ब्रोग्ली समीकरण – फ्रांसीसी वैज्ञानिक लुई दी ब्रोग्ली ने सन १९२४ में यह सुझाव दिया कि पदार्थ की प्रकृति द्विक होती है अर्थात इसमें कण प्रकृति तथा तरंग की भांति प्रकृति दोनों होती है , इसके लिए उन्होंने एक समीकरण दिया जिसकी सहायता से सूक्ष्म कण का तरंगदैर्ध्य भी निकाल सकते हैं ।
दी ब्रोग्ली समीकरण की व्युत्पत्ति
E = hv प्लैंक के अनुसार
E = mc2 आइंस्टीन के अनुसार
अतः hv = mc2
h (c/λ) = mc2 ( since v=c/λ)
λ = h/mc
λ=h/mv
λ=h/p
हाइज़ेनबर्ग का अनिश्चितता का सिद्धान्त – जर्मन वैज्ञानिक हाइज़ेनबर्ग के अनुसार ” किसी अत्यंत सूक्ष्म गतिशील कण की स्थिति एवं उसके वेग का एक साथ यथार्थ निर्धारण असंभव है ” ।
इस नियम का गणितीय निरूपण निम्न है –
Δx.Δv ≥ h/4π m
Δx.Δp ≥ h/4π
Δx स्थिति में अनिश्चितता
Δv वेग में अनिश्चितता
Δp संवेग में अनिश्चितता
m कण का द्रव्यमान, h प्लैंक नियतांक
ऑर्बिटल – नाभिक के चारो और का वह त्रिविमीय क्षेत्र जहाँ इलेक्ट्रान के पाए जाने की संभावना सबसे अधिक होती है उसे ऑर्बिटल कहते हैं ।एक ऑर्बिटल में विपरीत चक्रण के अधिकतम २ इलेक्ट्रान रह सकते हैं । ऑर्बिटल में इलेक्ट्रॉन घनत्व का वितरण उसकी आकृति को निर्धारित करता है । आकृति के आधार पर इलेक्ट्रान चार प्रकार के होते हैं ।
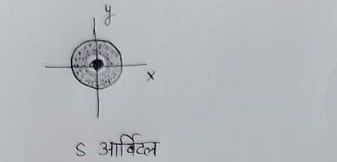
s ऑर्बिटल – इसकी आकृति गोलाकार होती है तथा इसमें गोलीय सममिति होती है ।
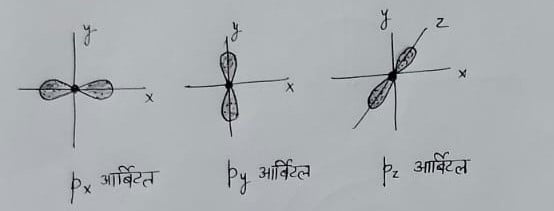
p ऑर्बिटल – इसकी आकृति डमरू के आकार की होती है , तथा अक्षों पर स्थिति के अनुसार ये तीन प्रकार के होते हैं ।
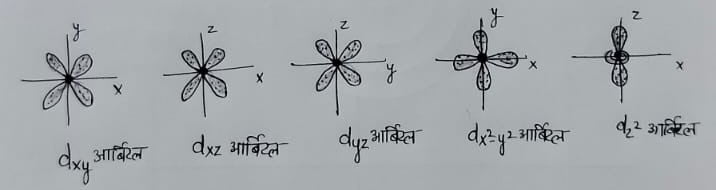
d ऑर्बिटल – इसकी आकृति डबल डमरू के आकर की होती है , तथा अक्षों पर स्थिति के अनुसार ये पांच प्रकार के होते हैं ।
f ऑर्बिटल – इसकी आकृति जटिल होती है । अक्षों पर स्थिति के अनुसार ये सात प्रकार के होते हैं ।
क्वांटम संख्याएं क्या होती हैं ? (<— इस लिंक पर क्लिक करें)
पॉली का अपवर्जन नियम – सन १९२५ में वैज्ञानिक पॉली द्वारा प्रस्तुत इस नियम के अनुसार ” एक परमाणु में किन्ही दो इलेक्ट्रानों की चारो क़्वांटम संख्याओं के मान समान नहीं हो सकते ” ।
इस नियम के निम्न अनुप्रयोग हैं –
1- इससे यह जान सकते हैं कि किसी कोश में अधिकतम कितने इलेक्ट्रान हो सकते हैं , यदि n कोश की संख्या है तो अधिकतम इलेक्ट्रान होंगे = 2n2
2 – उपकोश में अधिकतम इलेक्ट्रान होंगे, s में 2, p में 6 , d में 10 f में 14
3 – एक ऑर्बिटल में अधिकतम इलेक्ट्रान होंगें = 2
हुण्ड का नियम ( हुण्ड का अधिकतम बहुलता का नियम )-
वैज्ञानिक हुण्ड द्वारा प्रस्तुत इस नियम के अनुसार ” किसी उपकोश के ऑर्बिटलों में इलेक्ट्रॉनों का युग्मन तब तक नहीं होता जब तक उस उपकोश के प्रत्येक ऑर्बिटल में एक एक इलेक्ट्रान न भर जाय ” ।
अर्थात किसी उपकोश में इलेक्ट्रानों का वितरण इस प्रकार होता हैं कि अधिकतम अयुग्मित इलेक्ट्रान रह सकें ।

ऑफबाउ नियम – ऑफबाउ एक जर्मन भाषा का शब्द है जिसका अर्थ होता है रचना करना या बनाना । यह नियम इलेक्ट्रॉनिक विन्यास बनाने से सम्बंधित नियम है । इस नियम के अनुसार ” किसी तत्व का इलेक्ट्रॉनिक विन्यास बनाने के लिए उसके परमाणु की आद्य अवस्था में इलेक्ट्रॉन उसके ऑर्बिटलों को बढ़ती हुयी ऊर्जा के क्रम में रखकर भरते हैं”। विभिन्न ऑर्बिटल ऊर्जा के बढ़ते हुए क्रम में निम्न प्रकार से हैं –
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s 5f, 6d, 7p
examples
- B (Z=5) 1s2, 2s2, 2p1
- C (Z=6) 1s2 ,2s2,2p2
- N (Z=7) 1s2,2s2, 2p3
- O (Z=8) 1s2, 2s2 , 2p4
- F (Z=9) 1s2 ,2s2, 2p5
- Ne(Z=10) 1s2 ,2s2 ,2p6
- Na(Z=11) 1s2 ,2s2,2p6 ,3s1
तत्वों के इलेक्ट्रॉनिक विन्यास
| परमाणु क्रमांक | तत्व | इलेक्ट्रॉनिक विन्यास |
| 1 | Hydrogen | 1s1 |
| 2 | Helium | 1s2 |
| 3 | Lithium | [He]2s1 |
| 4 | Beryllium | [He]2s2 |
| 5 | Boron | [He]2s22p1 |
| 6 | Carbon | [He]2s22p2 |
| 7 | Nitrogen | [He]2s22p3 |
| 8 | Oxygen | [He]2s22p4 |
| 9 | Fluorine | [He]2s22p5 |
| 10 | Neon | [He]2s22p6 |
| 11 | Sodium | [Ne]3s1 |
| 12 | Magnesium | [Ne]3s2 |
| 13 | Aluminum | [Ne]3s23p1 |
| 14 | Silicon | [Ne]3s23p2 |
| 15 | Phosphorus | [Ne]3s23p3 |
| 16 | Sulfur | [Ne]3s23p4 |
| 17 | Chlorine | [Ne]3s23p5 |
| 18 | Argon | [Ne]3s23p6 |
| 19 | Potassium | [Ar]4s1 |
| 20 | Calcium | [Ar]4s2 |
| 21 | Scandium | [Ar]3d14s2 |
| 22 | Titanium | [Ar]3d24s2 |
| 23 | Vanadium | [Ar]3d34s2 |
| 24 | Chromium | [Ar]3d54s1 |
| 25 | Manganese | [Ar]3d54s2 |
| 26 | Iron | [Ar]3d64s2 |
| 27 | Cobalt | [Ar]3d74s2 |
| 28 | Nickel | [Ar]3d84s2 |
| 29 | Copper | [Ar]3d104s1 |
| 30 | Zinc | [Ar]3d104s2 |
| 31 | Gallium | [Ar]3d104s24p1 |
| 32 | Germanium | [Ar]3d104s24p2 |
| 33 | Arsenic | [Ar]3d104s24p3 |
| 34 | Selenium | [Ar]3d104s24p4 |
| 35 | Bromine | [Ar]3d104s24p5 |
| 36 | Krypton | [Ar]3d104s24p6 |
| 37 | Rubidium | [Kr]5s1 |
| 38 | Strontium | [Kr]5s2 |
| 39 | Yttrium | [Kr]4d15s2 |
| 40 | Zirconium | [Kr]4d25s2 |
| 41 | Niobium | [Kr]4d45s1 |
| 42 | Molybdenum | [Kr]4d55s1 |
| 43 | Technetium | [Kr]4d55s2 |
| 44 | Ruthenium | [Kr]4d75s1 |
| 45 | Rhodium | [Kr]4d85s1 |
| 46 | Palladium | [Kr]4d10,5s0 |
| 47 | Silver | [Kr]4d105s1 |
| 48 | Cadmium | [Kr]4d105s2 |
| 49 | Indium | [Kr]4d105s25p1 |
| 50 | Tin | [Kr]4d105s25p2 |
| 51 | Antimony | [Kr]4d105s25p3 |
| 52 | Tellurium | [Kr]4d105s25p4 |
| 53 | Iodine | [Kr]4d105s25p5 |
| 54 | Xenon | [Kr]4d105s25p6 |
| 55 | Cesium | [Xe]6s1 |
| 56 | Barium | [Xe]6s2 |
| 57 | Lanthanum | [Xe]5d16s2 |
| 58 | Cerium | [Xe]4f15d16s2 |
| 59 | Praseodymium | [Xe]4f36s2 |
| 60 | Neodymium | [Xe]4f46s2 |
| 61 | Promethium | [Xe]4f56s2 |
| 62 | Samarium | [Xe]4f66s2 |
| 63 | Europium | [Xe]4f76s2 |
| 64 | Gadolinium | [Xe]4f75d16s2 |
| 65 | Terbium | [Xe]4f96s2 |
| 66 | Dysprosium | [Xe]4f106s2 |
| 67 | Holmium | [Xe]4f116s2 |
| 68 | Erbium | [Xe]4f126s2 |
| 69 | Thulium | [Xe]4f136s2 |
| 70 | Ytterbium | [Xe]4f146s2 |
| 71 | Lutetium | [Xe]4f145d16s2 |
| 72 | Hafnium | [Xe]4f145d26s2 |
| 73 | Tantalum | [Xe]4f145d36s2 |
| 74 | Tungsten | [Xe]4f145d46s2 |
| 75 | Rhenium | [Xe]4f145d56s2 |
| 76 | Osmium | [Xe]4f145d66s2 |
| 77 | Iridium | [Xe]4f145d76s2 |
| 78 | Platinum | [Xe]4f145d96s1 |
| 79 | Gold | [Xe]4f145d106s1 |
| 80 | Mercury | [Xe]4f145d106s2 |
| 81 | Thallium | [Xe]4f145d106s26p1 |
| 82 | Lead | [Xe]4f145d106s26p2 |
| 83 | Bismuth | [Xe]4f145d106s26p3 |
| 84 | Polonium | [Xe]4f145d106s26p4 |
| 85 | Astatine | [Xe]4f145d106s26p5 |
| 86 | Radon | [Xe]4f145d106s26p6 |
| 87 | Francium | [Rn]7s1 |
| 88 | Radium | [Rn]7s2 |
| 89 | Actinium | [Rn]6d17s2 |
| 90 | Thorium | [Rn]6d27s2 |
| 91 | Protactinium | [Rn]5f26d17s2 |
| 92 | Uranium | [Rn]5f36d17s2 |
| 93 | Neptunium | [Rn]5f46d17s2 |
| 94 | Plutonium | [Rn]5f67s2 |
| 95 | Americium | [Rn]5f77s2 |
| 96 | Curium | [Rn]5f76d17s2 |
| 97 | Berkelium | [Rn]5f97s2 |
| 98 | Californium | [Rn]5f107s2 |
| 99 | Einsteinium | [Rn]5f117s2 |
| 100 | Fermium | [Rn]5f127s2 |
| 101 | Mendelevium | [Rn]5f137s2 |
| 102 | Nobelium | [Rn]5f147s2 |
| 103 | Lawrencium | [Rn]5f147s27p1 |
| 104 | Rutherfordium | [Rn]5f146d27s2 |
| 105 | Dubnium | *[Rn]5f146d37s2 |
| 106 | Seaborgium | *[Rn]5f146d47s2 |
| 107 | Bohrium | *[Rn]5f146d57s2 |
| 108 | Hassium | *[Rn]5f146d67s2 |
| 109 | Meitnerium | *[Rn]5f146d77s2 |
| 110 | Darmstadtium | *[Rn]5f146d97s1 |
| 111 | Roentgenium | *[Rn]5f146d107s1 |
| 112 | Copernium | *[Rn]5f146d107s2 |
| 113 | Nihonium | *[Rn]5f146d107s27p1 |
| 114 | Flerovium | *[Rn]5f146d107s27p2 |
| 115 | Moscovium | *[Rn]5f146d107s27p3 |
| 116 | Livermorium | *[Rn]5f146d107s27p4 |
| 117 | Tennessine | *[Rn]5f146d107s27p5 |
| 118 | Oganesson | *[Rn]5f146d107s27p6 |