SYLLABUS
प्रैक्टिकल कॉपी में लिखना है |
लवण – अम्ल तथा क्षार की अभिक्रिया से जल के अतिरिक्त जो पदार्थ बनता है उसे लवण कहते हैं। example: NaOH + HCl => NaCl + H2O
अम्लीय मूलक (ऋणायन )- लवण का वह भाग जो अम्ल से आता है उसे अम्लीय मूलक कहते हैं । जैसे सोडियम क्लोराइड में क्लोराइड आयन (Cl–)।
क्षारीय मूलक (धनायन )- लवण का वह भाग जो क्षार से आता है उसे क्षारीय मूलक कहते हैं । जैसे सोडियम क्लोराइड में सोडियम आयन (Na+) ।
लवण विश्लेषण – दिए गए लवण में उपस्थित अम्लीय मूलक तथा क्षारीय मूलक की पहचान प्रयोगशाला में रासायनिक परीक्षणों द्वारा की जाती है , इसे लवण विश्लेषण कहतें हैं ।
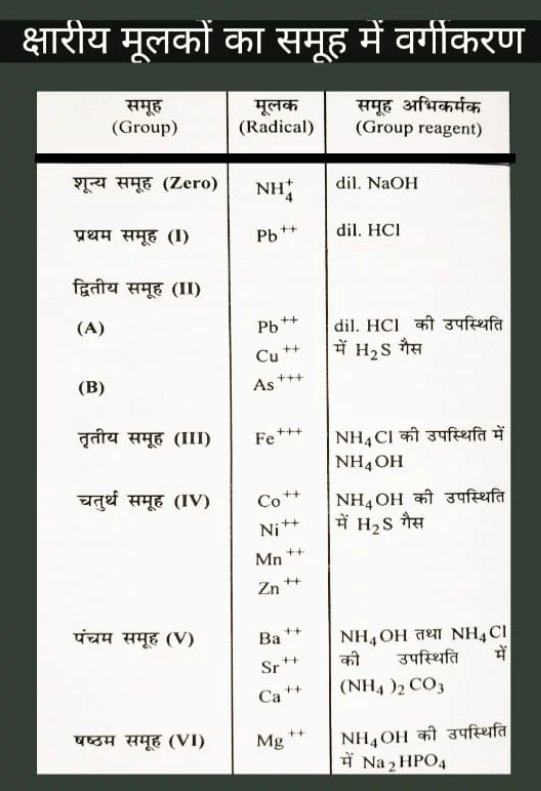
अम्लीय मूलकों का वर्गीकरण
प्रथम समूह – इस समूह में वे अभिकर्मक हैं जो dil H2SO4 से अभिक्रिया करते हैं , तथा विशिष्ट रंग या गंध वाली गैस देते हैं ।
इस समूह में निम्न अम्लीय मूलक हैं –
- कार्बोनेट CO3– –
- सल्फाइड S– –
- सल्फाइट SO3– –
- नाइट्राइट NO2–
- एसिटेट CH3COO–
द्वितीय समूह – इस समूह में वे अभिकर्मक हैं जो conc H2SO4 से अभिक्रिया करते हैं , तथा विशिष्ट रंग या गंध वाली गैस देते हैं ।
इस समूह में निम्न अम्लीय मूलक हैं –
- क्लोराइड Cl–
- ब्रोमाइड Br–
- आयोडाइड I–
- नाइट्रेट NO3–
- ऑक्सलेट C2O4– –
तृतीय समूह – इस समूह में वे अम्लीय मूलक हैं जिनकी पहचान विशेष परीक्षण द्वारा की जाती है ।
इस समूह में निम्न अम्लीय मूलक हैं –
- सल्फेट SO4– –
- फॉस्फेट PO4– – –
यह प्रयोग नए पेज से लिखिए ।
प्रयोग संख्या – 01
उद्देश्य :- दिए गए लवण (मिश्रण) में एक अम्लीय मूलक तथा एक क्षारीय मूलक की पहचान कीजिये I
आवश्यक उपकरण :-टेस्ट ट्यूब,फ़िल्टर पेपर ,बर्नर, स्प्रिट लैम्प , टेस्ट ट्यूब होल्डर ,अभिकर्मक इत्यादि I
प्रेक्षण तालिका :- अम्लीय मूलक की पहचान करना –
| क्र0सं0 | प्रयोग | प्रेक्षण | निष्कर्ष |
| 1 | मिश्रण +तनु H2SO4 (ठन्डे में) थोड़ा सा गर्म करने पर | कोई क्रिया नहीं | प्रथम समूह अनुपस्थित |
| 2 | (i) मिश्रण + सांद्र H2SO4 थोड़ा सा गर्म करने पर | तीक्ष्ण गंधयुक्त गैस | द्वितीय समूह संभव |
| (ii) परखनली के मुख पर NH4OH से भीगी छड़ लाने पर | सफ़ेद धुआं निकलता है | Cl– निश्चित | |
| (iii)मिश्रण + तनु HNO3 +AgNO3 | सफ़ेद अवक्षेप , NH4OH में विलेय | Cl– निश्चित |
रासायनिक अभिक्रियाएं :-
2NaCl + H2SO4 ——-> Na2SO4 +2HCl
NH4OH + HCl ———> NH4Cl + H2O
NaCl + AgNO3 ——-> AgCl + NaNO3
प्रेक्षण तालिका :- क्षारीय मूलक की पहचान करना –
| क्र0सं0 | प्रयोग | प्रेक्षण | निष्कर्ष |
| 1 | मिश्रण + NaOH थोड़ा सा गर्म करने पर | अमोनिया की गंध आती है | NH4+ संभव |
| 2 | परखनली के मुख पर NH4OH से भीगी छड़ लाने पर | सफ़ेद धुआं निकलता है | NH4+ निश्चित |
रासायनिक अभिक्रियाएं :-
NH4Cl + NaOH —–> NaCl + H2O + NH3
NH3 + HCl —–> NH4Cl
परिणाम :- दिए गए लवण में उपस्थित एक अम्लीय मूलक तथा एक क्षारीय मूलक निम्न हैं –
(i) अम्लीय मूलक …. Cl– ( क्लोराइड आयन )
(ii) क्षारीय मूलक …… NH4+ ( अमोनियम आयन )
प्रयोग संख्या -02
उद्देश्य :-आक्सैलिक अम्ल का M/30 सांद्रता का 250mL मानक विलयन बनाकर अनुमापन (Titration) द्वारा दिए गए KMnO4 विलयन की मोलरता ज्ञात कीजिए |
आवश्यक उपकरण एवं सामग्री :-ब्यूरेट, पिपेट, कोनिकल फ्लास्क, मापक फ्लास्क, ऑक्सेलिक अम्ल, रासायनिक तुला, KMnO4विलयन, बर्नर ,आसुत जल आदि |
सिद्धांत :- ऑक्सेलिक (H2C2O4.2H2O)अम्ल का M/30 सांद्रता का 250 mL मानक विलयन बनाने के लिए आवश्यक अम्ल की मात्रा(w)-
w =अणुभार×मोलरता×आयतन/1000
w =126×(1/30)×250/1000
w =1.050 ग्राम
रासायनिक तुला पर 1.050 ग्राम आक्सैलिक अम्ल तोल कर एक कोनिकल फ्लास्क में 250mL आसुत जल में घोलें तथा जल अपघटन रोकने के लिए थोड़ा सान्द्र H2SO4 मिलाये | इस M/30 आक्सैलिक अम्ल के सांद्रता वाले विलयन का अनुमापन KMnO4 विलयन से करने पर निम्न अभिक्रिया होती है-
MnO4– + 8H+ +5e– —> Mn++ 4H2O ]×2
C2O4– – —> 2CO2 + 2e– ]×5
अथवा सपूर्ण अभिक्रिया:-
2 MnO4– +16 H+ + 5 C2O4– – —->2Mn++ + 8H2O + 10CO2
सूचक :- KMnO4 एक स्वयं सूचक(self indicator)है|
अन्तिम बिन्दु :- रंगहीन से स्थायी गुलाबी
विधि :- (1)आक्सैलिक अम्ल (ठोस) की 1.050 ग्राम मात्रा को रासायनिक तुला पर तोलिये |
(2) तोली गयी मात्रा को कांच की कीप द्वारा कोनिकल फ्लास्क में डालिए| इसमें धीरे-धीरे जल मिलाइये तथा थोड़ा सांद्र H2SO4 डालिए |
(3) दिए गए KMnO4 विलयन को ब्यूरेट में भरिए तथा ब्यूरेट में भरे इस विलयन के तल का पाठ्यांक नोट कीजिये |
(4) M/30 सांद्रता के बनाये गए आक्सैलिक अम्ल के विलयन को पिपेट की सहायता से कोनिकल फ्लास्क में डालिये |
(5) इस विलयन में एक परखनली भरकर तनु H2SO4 मिलाइये ,तथा इसे लगभग 60-700C तक गर्म कीजिये |
(6) अब ब्यूरेट से KMnO4 विलयन को बूँद-बूँद करके कोनिकल फ्लास्क में आक्सैलिक अम्ल में तब तक मिलाइये जब तब विलयन स्थायी रूप से हल्का गुलाबी न हो जाए | इस दौरान फ्लास्क को हिलाते रहिये |
(7) इस प्रयोग की 3-4 बार पुनरावृत्ति कीजिये तथा कम से कम तीन समान पाठयांक लीजिये |

प्रेक्षण :- (1) तोलन नली का लगभग भार =7.8 gram
(2) तोलन नली+आक्सैलिक अम्ल का भार= 8.850 gram
(3) खाली तोलन नली का सही भार =7.8842 gram
(4) आक्सैलिक अम्ल का भार =1.050 gram
(5) पिपेट की धारिता = 25mL
| क्र0 सं0 | आक्सैलिक अम्ल | ब्यूरेट का पाठयांक (Initial) | ब्यूरेट का पाठयांक (Final) | प्रयुक्त KMnO4 |
|---|---|---|---|---|
| 1 | 25 mL | 0.00 mL | 6.6 mL | 6.6 mL |
| 2 | 25 mL | 0.00 mL | 6.7 mL | 6.7 mL |
| 3 | 25 mL | 0.00 mL | 6.7 mL | 6.7 mL |
(observation table)
प्रयुक्त KMnO4 =6.7 mL (समान पाठयांक)
गणनाएं :-N1×V1 (KMn04) =N2×V2 (आक्सैलिक अम्ल)
n1×M1×V1(KMn04)= n2×M2×V2(आक्सैलिक अम्ल)
5×M1×6.7 = 2×(1/30) ×25
M1 = 0.05 mol/L
परिणाम :-दिए गए विलयन की मोलरता = 0.05 M
सावधानियां :-
(1) अनुमापन करते समय ब्यूरेट के ऊपर से फनल (कीप) हटा देना चाहिए |
(2) कोनिकल फ्लास्क को आक्सैलिक अमल विलयन से खंगालना चाहिए |
(3) ब्यूरेट के जेट में वायु के बुलबुले नहीं रहने चाहिए |
(4) पिपेट की नोक में बचा द्रव फूँक मार कर नहीं निकालना चाहिए क्योंकि वह निर्धारित आयतन से अतिरिक्त होता है|
प्रयोग संख्या – 03
उद्देश्य :- दिए गए लवण (मिश्रण) में एक अम्लीय मूलक तथा एक क्षारीय मूलक की पहचान कीजिये I
आवश्यक उपकरण :-टेस्ट ट्यूब,फ़िल्टर पेपर ,बर्नर, स्प्रिट लैम्प , टेस्ट ट्यूब होल्डर ,अभिकर्मक इत्यादि I
प्रेक्षण तालिका :- अम्लीय मूलक की पहचान करना –
| क्र0सं0 | प्रयोग | प्रेक्षण | निष्कर्ष |
|---|---|---|---|
| 1 | मिश्रण +तनु H2SO4 (ठन्डे में) थोड़ा सा गर्म करने पर | कोई क्रिया नहीं | प्रथम समूह अनुपस्थित |
| 2 | (i) मिश्रण + सांद्र H2SO4 थोड़ा सा गर्म करने पर | तीक्ष्ण गंधयुक्त गैस | द्वितीय समूह संभव |
| (ii) परखनली के मुख पर NH4OH से भीगी छड़ लाने पर | सफ़ेद धुआं निकलता है | Cl– निश्चित | |
| (iii)मिश्रण + तनु HNO3 +AgNO3 | सफ़ेद अवक्षेप , NH4OH में विलेय | Cl– निश्चित |
रासायनिक अभिक्रियाएं :-
2NaCl + H2SO4 ——-> Na2SO4 +2HCl
NH4OH + HCl ———> NH4Cl + H2O
NaCl + AgNO3 ——-> AgCl + NaNO3
प्रेक्षण तालिका :- क्षारीय मूलक की पहचान करना –
| क्र0सं0 | प्रयोग | प्रेक्षण | निष्कर्ष |
|---|---|---|---|
| 1 | मिश्रण + NaOH थोड़ा सा गर्म करने पर | अमोनिया की गंध आती है | NH4+ संभव |
| 2 | परखनली के मुख पर NH4OH से भीगी छड़ लाने पर | सफ़ेद धुआं निकलता है | NH4+ निश्चित |
रासायनिक अभिक्रियाएं :-
NH4Cl + NaOH —–> NaCl + H2O + NH3
NH3 + HCl —–> NH4Cl
परिणाम :- दिए गए लवण में उपस्थित एक अम्लीय मूलक तथा एक क्षारीय मूलक निम्न हैं –
(i) अम्लीय मूलक Cl– ( क्लोराइड आयन )
(ii) क्षारीय मूलक NH4+ ( अमोनियम आयन )
