प्रस्तुतकर्ता : नील्स बोर (सन 1913)
आधार : मैक्स प्लैंक के क्वांटम सिद्धांत पर आधारित
पूर्व मॉडल : रदरफोर्ड का परमाणु मॉडल ( इसकी कमियों को दूर किया बोर मॉडल ने )
बोर के परमाणु मॉडल के प्रमुख बिंदु निम्न हैं।
1-परमाणु के इलेक्ट्रॉन नाभिक के चारो ओर कुछ निश्चित गोलाकार कक्षाओं में घूमते हैं जिन्हे स्थाई कक्षाएं कहते हैं।
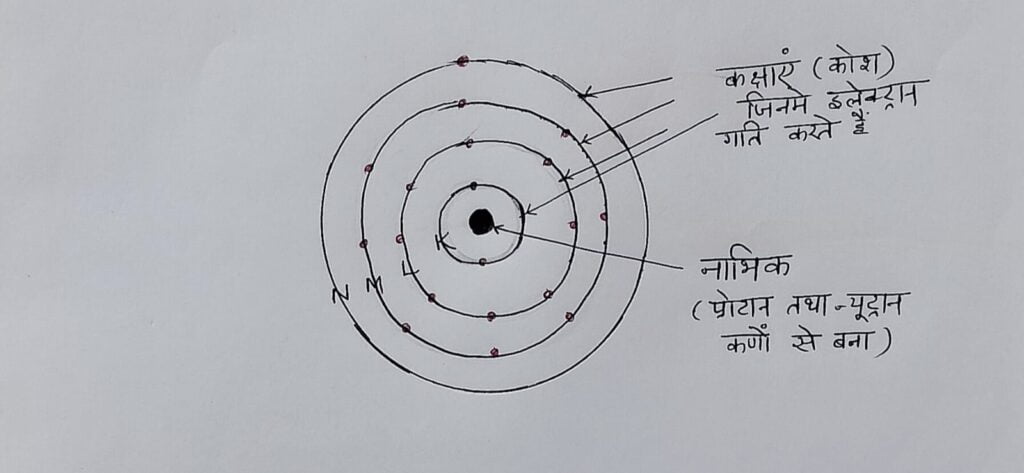
2- इलेक्ट्रॉन जब इन स्थाई कक्षाओं में घूमते हैं तो उनकी ऊर्जा में कोई कमी नहीं आती है ,यद्यपि नाभिक से कक्षा जितनी दूर होती है उतनी उसकी ऊर्जा अधिक होती है।
3- स्थाई कक्षाओं में गति करते हुए इलेक्ट्रॉन पर दो बल कार्य करते हैं। एक तो नाभिक ओर लगता है जिसे कूलाम का स्थिरवैद्युत आकर्षण बल कहते हैं। यह अभिकेंद्री बल होता है। जबकि दूसरा बल नाभिक से बाहर की ओर लगता है जिसे अपकेंद्री बल कहते हैं
ये दोनों बल एक दूसरे के बराबर तथा विपरीत होते हैं जिससे इलेक्ट्रॉन अपनी कक्षा में स्थित रहता है।

4- जब इलेक्ट्रॉन को बाहर से ऊर्जा दी जाती है तो यह क्वांटम में ऊर्जा ग्रहण करके त्वरित होता है तथा उच्च कक्षा में चला जाता है|

यदि किसी कक्षा का इलेक्ट्रॉन क्वांटम में ऊर्जा मुक्त करता है, या सकी ऊर्जा में कमी आती है तो इलेक्ट्रॉन निचली कक्षा में चला जाता है ,परन्तु जब तक इलेक्ट्रॉन को न तो बाहर से ऊर्जा मिलती है न वह ऊर्जा खोता है ,तब तक उसी कक्षा में गतिशील रहता है तथा उसकी ऊर्जा उतनी बनी रहती है।
5- इलेक्ट्रॉन किसी कक्षा में तब तक घूमता रहता है जब तक उसका कोणीय संवेग(mvr) का मान nh/2π होता है |जिसमे n उसकी कक्ष की संख्या है| पहली कक्षा के लिए n=1

See this video
